研究紹介と寄付のお願い
当科の特色をよりご理解いただくために、当科の医師が取り組んでいる研究をご紹介いたします。
脳腫瘍の多くは、いまだに根治困難です。
脳血管障害は時間との勝負ですが、救命できた場合でも、社会復帰のためには多くの改善すべき課題が残っています。
当科の医師達は、これらの難治性脳神経疾患の治療成績改善を目指して、不断の努力を続けています。
研究を進めるためには、どうしてもある程度の資金が必要です。
もし研究の趣旨にご賛同いただける場合には、皆様からの温かいご寄付をお願いしたく、何卒よろしくお願い申し上げます。
下記リンクより、<目的2(各診療科)><奨学寄付申込書>へお進みください。<研究寄付先>に脳神経外科とご記入いただき、脳神経外科への一般的な寄付の場合は研究テーマ無しに〇、特定のテーマへの寄付の場合は研究テーマのご記入をお願い致します。寄付先研究者名欄は、研究1〜3)は佐々木光、研究4〜6)は片山正輝、研究7〜9)あるいは特定の研究テーマがない場合は空欄でお願い致します。
研究内容について
ページ内リンク
悪性髄膜腫に対する新規治療法の開発
髄膜腫の大部分は良性腫瘍(WHO grade 1)であり、手術で全摘出されれば根治可能ですが、20〜30%は、手術や放射線後も再発を繰り返す、悪性髄膜腫(WHO grade 2〜3)です。近年、他臓器のがんや他の中枢神経系腫瘍と同様に、髄膜腫においても、ドライバー遺伝子異常(腫瘍の発生や進行に直接的な役割を果たす遺伝子異常)に関する知識が蓄積し、髄膜腫の発生部位やサブタイプに密接に関係することが示されています。悪性髄膜腫の大部分が、NF2という遺伝子の変異を伴うことが知られていますが、NF2変異に関連するmTORという分子経路の阻害薬は無効です。悪性髄膜腫に対して有効な薬物療法は、国際的にも報告されておらず、新規の薬物治療の開発は、いわゆるアンメットメディカルニーズです。
当科の医師は、国内初の悪性髄膜腫に対する薬物療法臨床試験(多施設共同試験:慶應大学、藤田医科大学、北海道大学、東北大学、九州大学、 https://rctportal.niph.go.jp/s/detail/um?trial_id=jRCT2031190074)を研究代表者として実施し、今後に繋がりうる結果が得られました。また、悪性髄膜腫の遺伝子発現を網羅的に分析することにより、有望な結果が得られました(慶應義塾大学病院腫瘍センター、藤田医科大学腫瘍医学研究センターとの共同研究)。
画像AI技術による、グリオーマの分子診断予測プログラムの開発
原発性脳腫瘍は日本で約30,000人/年発生し、(グリオーマ)はその約1/4をしめる代表的脳腫瘍です。脳内へ浸潤性に発育するため、手術だけで根治させることは困難であり、また放射線や薬物療法の効果も限定的で、多くの患者さんで生命に関わる疾患です。
近年、遺伝子に基づく分類の重要性が認識され、グリオーマは、Isocitrate Dehydrogenase (IDH)遺伝子変異と1p/19q共欠失(染色体1番短腕、19番長腕の共欠失)の有無により、3型に分類されることとなりました(「代表的対象疾患と治療法:脳腫瘍」の図参照)。3型分類は、化学療法反応性や生命予後と強く相関するため、手術戦略や治療方針に大きく影響します。
脳は機能の温存が極めて重要な臓器である一方、グリオーマにおいては、手術での摘出率(摘出割合)が生命予後と関係します(できるだけ摘出する方が良い)。この両者を同時に満たす必要がありますが、グリオーマに対しては、上で述べた組織型(3型分類)に関わらず、一律に、まずできるだけ摘出するという方針がとられています。そして病理診断は、摘出手術の後にようやく判明します。
一方、他の臓器のがんにおいては、通常、まず生検(胃カメラや局所麻酔でまず病理診断を調べること)が行われ、その結果に基づいて、手術方針や補助療法が立案されます。グリオーマにおいては、生検のためにも開頭を要することが多く、生検をすることが習慣化されていません。そこで、生検に代わる手段として、CTやMRI などの画像から組織型が予測できれば、手術戦略も含めて、個々の患者さんに適切な治療を提供することが可能となると考えました(図)。
当科の医師は、人工知能(AI)技術の専門家、脳画像診断の専門家などとチームを結成し、画像所見から、AI技術を用いて、
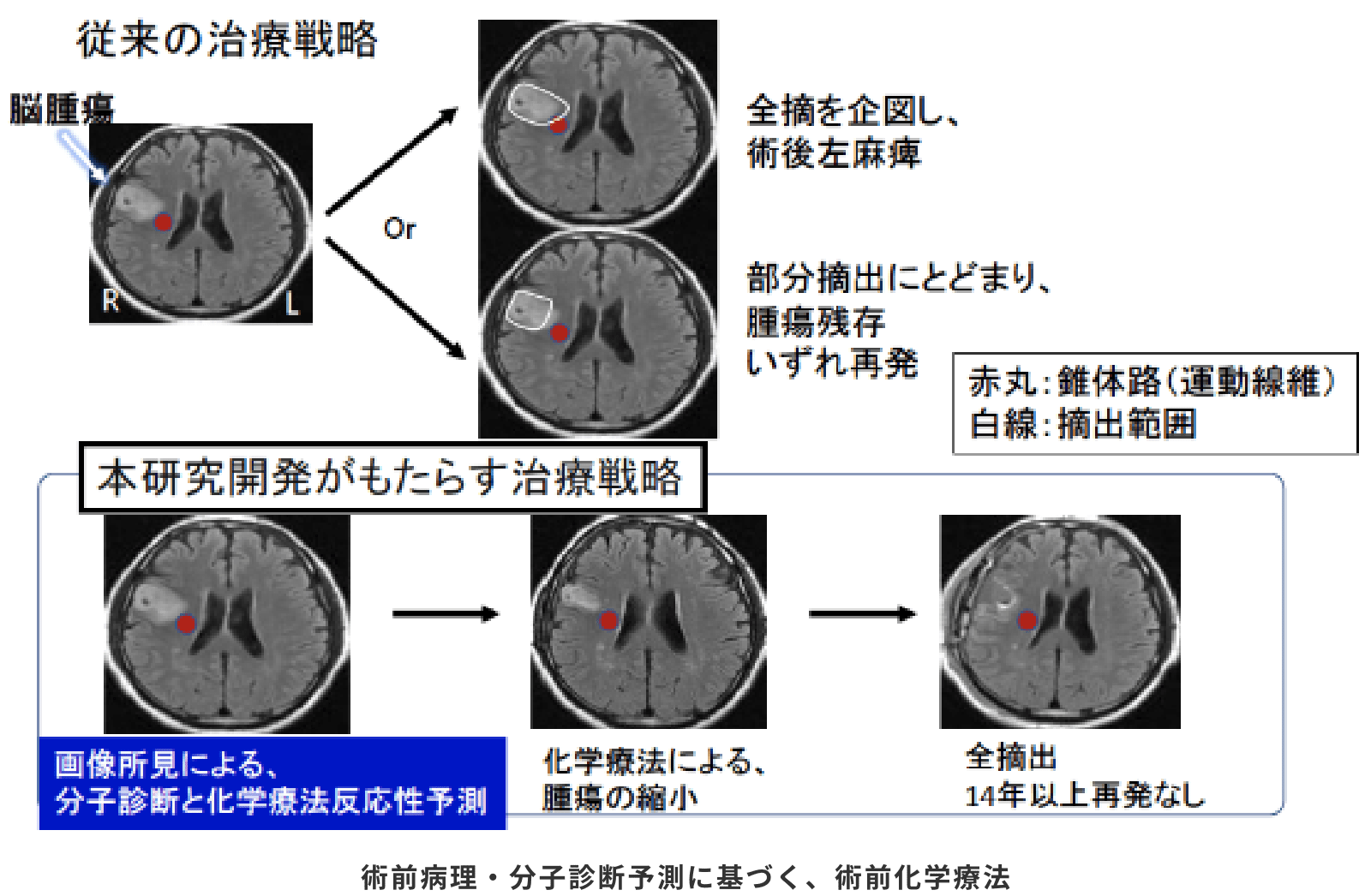
術前化学療法とは、化学療法により癌を縮小させた後に摘出することにより、機能・生命予後の改善を期する治療戦略です。
この研究開発が製品化されれば、化学療法の効果が期待されるグリオーマに対して、術前化学療法が普及することが期待されます。
力触覚(ハプティクス)技術の脳外科手術への応用
力触覚(ハプティクス)とは、慶應義塾大学理工学部の大西公平先生、横浜国立大学の下野誠通先生らにより開発された、触覚や力を伝送・増幅・記録することを可能とする技術です。
当科の医師は、この技術を脳外科手術に応用すれば、腫瘍や組織の硬さに基づいて手術中リアルタイムの病理診断が可能になるのではと着想し、下野先生達と共同で、同技術を搭載した脳外科手術用鑷子のプロトタイプを開発、特許を取得しました(特許第7347774号)。
このプロトタイプ鑷子では、マウスでの実験で、悪性神経膠腫、髄膜腫、正常脳を硬さにより識別可能であることが確認されました。
現在、プロトタイプ鑷子によるヒト脳腫瘍の識別機能の確認と、操作性や感度の向上のためのバージョンアップ、また将来的には、ナビゲーションシステムとの連動、遠隔手術支援機器への搭載などなどを目指して、研究を進めています。

脳動脈瘤治療に利用するマイクロカテーテルの開発
脳動脈瘤の脳血管内治療では、マイクロカテーテルを通じてプラチナコイルを動脈瘤内へ誘導します。
治療を通じてマイクロカテーテルの位置を認識するための工夫を凝らしたマイクロカテーテルの開発を行っています。
現在は一部製品化に成功して実用に至っております。さらなる向上のために研究、開発をすすめています。
安全な患者拘束帯の開発
脳疾患を罹患した患者さんは、意識障害、不穏状態のために安静が保てない場合が少なくありません。
入院中にベッドから転落する場合もあります。
当科の医師たちは、患者様のカラダに優しく、かつ安静を保つ患者拘束帯の開発を行っております。
食欲増進因子グレリンと食欲、サルコペニア、フレイルの関係性
についての研究
脳疾患に罹患した患者さんは、食欲が減退していることが少なくありません。
当科の医師たちは、当院歯科・口腔外科と共同で内因性成長ホルモン分泌促進ペプチドであるグレリンの摂食促進作用、抗筋萎縮作用に注目し、未だ検討されてない血中グレリン濃度と食欲、サルコペニア、口腔周囲筋の筋力・機能の定量的な関係、グレリン分泌促進を要する病態を明らかにする研究を続けています。
脳腫瘍遺伝子解析研究
(効果的治療法選択のための脳腫瘍の遺伝子解析)
従来、中枢神経系腫瘍は、組織や細胞の形態を顕微鏡でみて、その起源である細胞(グリア細胞、くも膜細胞など)を推測することにより、診断されてきました。しかし近年、腫瘍の持つ遺伝子情報が、組織や細胞の形態以上に、治療に対する反応性や患者さんの予後と関係することが示され、2016年のWHO診断基準(改訂4版)以降、脳腫瘍の病理診断は、形態の特徴と遺伝子情報を統合して診断することと決められました。特にグリオーマは、遺伝子情報だけで診断されると言っても良い基準となっています(「代表的対象疾患と治療法:脳腫瘍」参照)。
しかし、少なくても本記載時点で、正式な病理診断に必要な遺伝子検査すら、世界でも日本でも、保険適用となっていません。また、脳腫瘍の多くは、今でも根治困難です。難治性脳腫瘍や稀な脳腫瘍の遺伝子情報を明らかにすることにより、脳腫瘍の発生メカニズム、悪性化メカニズムを解明し、新規治療法を開発することが必要です。
当科では、本研究に同意いただいた患者さんの標本を用いて、発生・悪性化メカニズム解明、新規治療法開発のための研究を行なっているほか、グリオーマに対しては病理診断に必要な検査や抗がん剤に対する反応性と関係する遺伝子検査を行なっています(患者さんの費用負担なし)。
- グリオーマの遺伝子検査は、他院で手術された患者さんでも受けることができます。
脳腫瘍の統合的病理・遺伝子診断システムの開発
他臓器の癌と同様に、中枢神経系腫瘍においては、腫瘍の遺伝子情報を網羅的に調べて、その遺伝子の特徴に応じて治療法を個別化する、いわゆる精密医療(プレシジョンメディシン)の方向性にあります。そのため、日本でも2019年より、網羅的ながん遺伝子パネル検査が保険適用となりました。
しかし、保険でのがん遺伝子パネル検査は、一人の患者さんで一生に一回しか認められておらず、どのタイミングで行うか判断が難しいことがあります。
当科は、網羅的な遺伝子検査結果と病理診断との整合性を調べることで、より精度の高い次世代の病理・遺伝子統合診断法を開発することを目的として、鹿児島大学病院を代表とする「脳腫瘍の統合的病理・遺伝子診断システムの開発」に参加しています。
本研究では、脳腫瘍(特にグリオーマ)に関連する51の遺伝子変異、37の融合遺伝子を調べます(患者さんの費用負担なし)。
保険でのがん遺伝子パネル検査の前段階の検査として行うことも可能です。
- 当科で手術を受けた患者さんだけが対象となります。
多施設脳卒中レジストリ「脳卒中データバンク(Japan Stroke Data Bank:JSDB)」を用いた我が国の脳卒中医療の研究
脳梗塞、脳出血、くも膜下出血を合わせて脳卒中と呼びます。多くの方が脳卒中になりますが、解明されていないことが多くあります。この研究は、全国の病院からこれまでのカルテ情報等を収集し、脳卒中患者の治療の実態及び予後を継続的に把握するとともに、治療成績を分析し、日本における脳卒中患者の治療 指針を検証することを目的としています。
国立循環器病センターが研究代表者であるこの研究に、当院は2006年から参加して脳卒中医療の研究に貢献しています。